2016年8月15日,国家食品药品监督管理总局发布了《关于全面加强食品药品监管系统法治建设的实施意见》。其中提到“力争2016年年底前,积极配合最高人民法院、最高人民检察院,出台有关严惩药品临床数据造假犯罪的司法解释。”
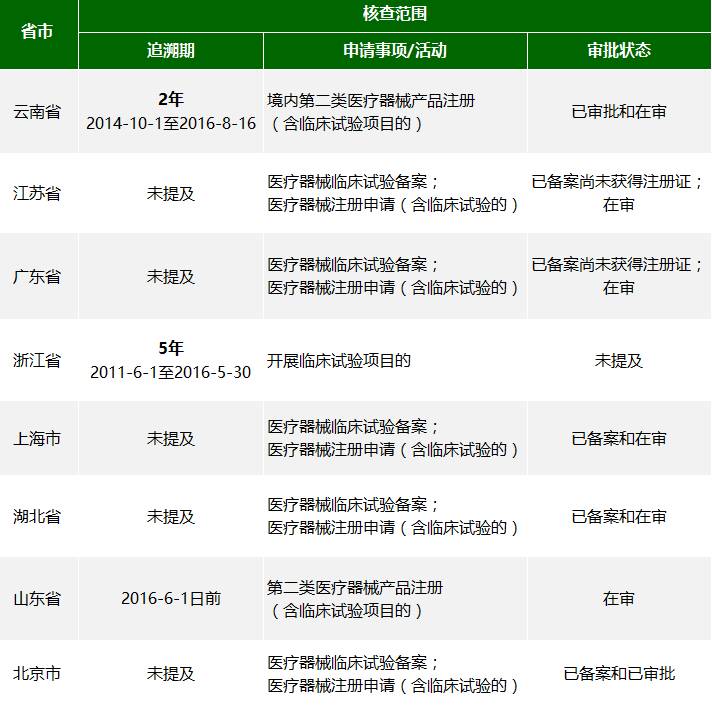
2016年8月16日,云南省食品药品监督管理局发布了关于开展医疗器械临床试验核查的通。截至目前,全国已经有9个省市展开了医疗器械临床试验真实性核查,以下是9省市检查范围对比(点击可查看大图):
关注CMDRA,在微信公众号主页面发送“喝茶”2个字即可获得更多相关主题微文。
云南省医疗器械临床试验核查的详细信息如下(点击屏幕左下方“阅读原文”,可跳转至官方链接):
核查范围>>
对省食品药品监督管理局2014年10月1日至本通告发布之日受理的境内第二类医疗器械注册(包括已审批和在审)产品临床试验项目进行回顾性检查。
核查依据>>
2016年6月1日之前开展的医疗器械临床试验依据《医疗器械临床试验规定》(原食品药品监管局令第5号),体外诊断试剂临床试验依据体外诊断试剂临床试验(研究)技术指导原则等相关要求;2016年6月1日起开展的医疗器械临床试验依据《医疗器械临床试验质量管理规范》(食品药品监管总局令第25号),体外诊断试剂临床试验依据《体外诊断试剂临床试验技术指导原则》。
核查步骤>>
(一)企业自查
自本通告发布之日起,全省在此次核查范围内的企业应按照核查依据开展临床试验相关情况自查,确保临床试验数据真实、可靠,原始数据保存完整。自查发现临床试验数据存在真实性和严重合规性问题的,按照法规要求,在审产品注册申请人应主动撤回注册申请;已取得注册证的注册人应主动申请注销注册证。
(二)监督抽查
省食品药品监督管理局将于2016年9月至10月组织开展医疗器械临床试验监督检查。在检查中发现临床试验数据存在真实性问题的,对已取得注册证的根据《医疗器械监督管理条例》第六十四条,由省食品药品监督管理局撤销已经取得的注册证,对该注册相关责任人及企业自撤销注册之日起五年内不再受理其申请;在审的根据《医疗器械注册管理办法》第三十九条或《体外诊断试剂注册管理办法》第四十九条的规定,对注册申请作出不予注册的决定,同时按照《中华人民共和国行政许可法》第七十八条,对该注册申请人给予警告,并自作出不予注册决定之日起一年内不再受理该行政许可申请。仅存在合规性问题的,对注册申请资料和发现的问题进行安全性和有效性综合评价,其中,对已取得注册证的,根据评价结果进行整改和再评价,再评价结果表明不能保证安全、有效的,由省食品药品监督管理局注销医疗器械注册证;对在审的,根据评价结果作出是否批准注册的决定。
9省市监督抽查时间汇总

主要内容>>
(一至十为真实性问题,十一至十六为合规性问题)
(一)注册申请提交的临床试验资料(临床试验合同、方案、报告)与临床试验机构保存的相应临床试验资料是否一致。
(二)注册申请提交的临床试验报告中数据是否与临床试验机构保存的原始记录和原始数据一致。
(三)注册申请的临床试验报告中临床试验人员签名及临床试验机构签章是否属实。
(四)伦理委员会是否保存所审查的文件资料,审查的临床试验方案/知情同意书版本及内容是否与执行的版本及内容一致。
(五)已签署的知情同意书版本是否与伦理审查通过的版本一致。
(六)已签署的知情同意书数量是否与临床试验报告中的病例数相符(包括筛选病例)。
(七)临床试验资料中试验产品的名称、规格型号是否与检测报告、临床试验报告上的内容一致。
(八)临床试验例数及观察时间是否与临床试验报告上的内容一致。
(九)临床试验数据与原始病历所载内容是否一致。
(十)病例报告表中填写的内容是否在原始病历、检验记录等原始记录中可追溯。
(十一)知情同意书签署的内容是否完整、规范。
(十二)临床试验机构执行的试验方案是否为同一版本(多中心)。
(十三)临床试验的原始数据收集、病例报告表是否由临床试验人员签字。
(十四)临床试验项目中主要职责的落实情况、合规情况。
(十五)临床试验记录情况、原始数据留存情况。
(十六)临床试验中发生的不良事件是否按规定记录和处理,并与临床试验报告一致。
<<精彩内容回顾>>
2016年1月21日至22日在京召开的全国医疗器械监督管理工作会议上,总局部署了2016年医疗器械监督管理重点工作,其中提到今年将适时启动医疗器械临床试验数据核查…
2016年2月27日,总局发布了《关于对日本富士瑞必欧株式会社的乙型肝炎病毒核心相关抗原(HBcrAg)检测试剂盒不予注册的公告》(2016年第44号)。宣布此次医疗器械临床试验数据核查中首个因临床试验数据存在真实性问题而不予注册的医疗器械产品,并在通告中详细阐述了该产品临床试验数据存在的5个主要问题。
2016年6月1日,《医疗器械临床试验质量管理规范》(2016年总局令第25号)实施。总局办公厅发布通知要求各级食品药品监督管理部门对辖区内自2016年6月1日起开展的医疗器械临床试验,应严格按照新《规范》的原则及要求适时开展日常监督检查。
2016年6月8日,总局发布了《关于开展医疗器械临床试验监督抽查工作的通告》(总局通告2016年第98号)。宣布于2016年6月至10月对在审注册申请中2016年6月1日前开展的临床试验项目(临床试验数据真实性、合规性)实施抽查,包括所有境内第三类及进口医疗器械在中国境内通过临床试验方式获取临床试验数据的注册申请项目。
2016年7月8日,国家食品药品监督管理总局发布了关于《2016年第一批医疗器械临床试验监督抽查项目》的通告(2016年第105号)公布了首批抽取的10个注册申请项目。
期间,全国已经有9个省市陆续发布了辖区内医疗器械临床试验真实性核查的通知。小编对其进行了一下汇总(包括真实性核查的启动时间),如下表所示。
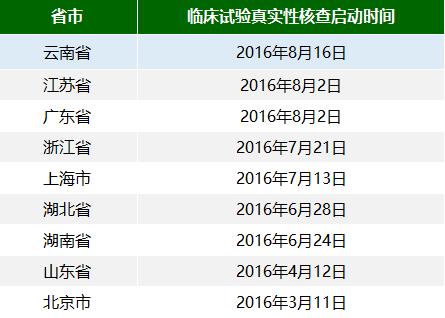
(注:山东省在2016年7月26日发布了开展医疗器械临床试验监督抽查的通知)
从检查范围来看,各省市根据辖区内临床试验开展的情况,定义了核查的范围,目前来看的最多的要追查5年之内的临床试验项目。详细信息整理如下:
浙江省将对《规范》实施前5年的临床试验进行真实性核查,要求全省所有医疗器械注册申请人(代理人)和临床试验机构应对2011年6月1日至2016年5月30日期间开展的临床试验项目开展自查。
北京市要求辖区内已进行医疗器械临床试验备案的单位(包括申请人、注册代理人)及已取得医疗器械产品注册证的注册人均须按照医疗器械临床试验等相关要求,开展临床试验数据及备案情况自查,确保临床试验数据真实、可靠,原始数据保存完整。
山东省4月12日发布的通知主要是针对省内第二类医疗器械临床试验真实性的核查。明确将山东省内未审批过的新产品,注册申请人申报的首个注册产品,治疗类仪器设备,体外诊断试剂列入核查范围。
其余省市的检查范围为:本省已进行医疗器械临床试验备案的单位(含注册代理人)且在审的医疗器械注册申请人涉及临床试验的。
从检查日程安排来看,监督抽查将从今年夏天一直延续到冬天...

江苏省>>省局将于2016年9月—12月对在审注册申请中2016年6月1日前开展的临床试验项目实施监督抽查,重点抽查本省首次审批产品、生产企业首个注册产品、治疗类产品、体外诊断试剂等产品。将抽调江苏省医疗器械生产监督检查员组成检查组,对抽查的临床试验项目进行现场检查。现场检查实施前,省局将另行通知相关的临床试验机构、注册申请人以及临床试验机构和注册申请人所在地的省辖市食品药品监管局。
广东省>>将于2016年9月—12月依据《医疗器械临床试验现场检查要点(2016年)》组织开展本省医疗器械临床试验的监督检查,对2016年6月1日前开展临床试验的在审第二类医疗器械注册申请进行抽查并公告抽查名单。我局将在检查前三天以书面形式通知相应的临床试验机构、注册申请人。临床试验机构在广东省外的,将书面告之临床试验机构所在地的省级食品药品监督管理局。
浙江省>>将于2016年8-10月组织检查组按照《通告》中的医疗器械临床试验现场检查程序和医疗器械临床试验现场检查要点开展监督抽查。现场检查实施前,将以书面方式通知相应的临床试验机构和注册申请人(代理人)。
上海市>>将于2016年8月组织开展本市医疗器械临床试验核查和监督抽查。配合国家食药监总局专项检查组,按照医疗器械临床试验现场检查程序对在审注册申请中2016年6月1日前开展的临床试验项目实施抽查,包括所有境内第三类及进口医疗器械在中国境内通过临床试验方式获取临床试验数据的注册申请项目。
湖北省>>于2016年7月中旬组织开展医疗器械临床试验监督抽查。
山东省>>将于2016年7月-11月分期分批组成检查组开展现场检查。现场检查实施前,将以书面形式通知相应的临床试验机构、注册申请人以及临床试验机构和注册申请人所在地的市级食品药品监督管理局。
对山东省食品药品监管局在审第二类医疗器械注册申请中2016年6月1日前开展的临床试验项目实施监督抽查。重点抽查本省以前未审批过的产品、生产企业首个注册产品、治疗类产品、诊断类产品和体外诊断试剂等,抽查重点和比例按照《山东省食品药品监督管理局关于开展第二类医疗器械临床试验真实性核查的通知》有关规定执行。其他产品综合考虑其风险程度、申请量比例、申请人情况、临床试验机构规模和承担项目数量等因素,按照一定比例抽取。
【著作权声明】本文由CMDRA整理,其中引用了政府公开信息,转载请注明作者为CMDRA微信订阅号。
|